식약처, 발사르탄 복용 환자 영향평가 발표
[그린포스트코리아 황인솔 기자] 고혈압 원료의약품 '발사르탄'에서 발암 가능 물질이 검출된 이후, 식품당국이 관련 위험성을 조사한 결과 위해성이 매우 낮다는 결론을 내렸다.
식품의약품안전처는 발사르탄 복용 환자에 대한 영향평가 결과 10만명 중 국제기준보다 낮은 0.5명에서 추가로 암이 발생하는 것으로 나타났다고 19일 밝혔다.
이는 국제의약품규제조화위원회(ICH) 가이드라인 기준인 10만 명 중 1명과 비교해 위해 정도가 낮은 수준이다.
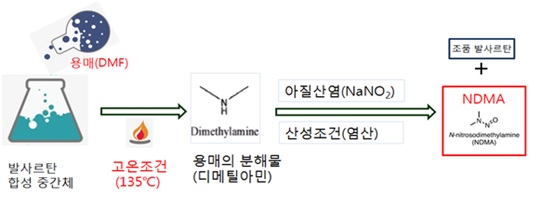
이와 함께 식약처는 사르탄 계열 의약품의 NDMA와 NDEA(N-니트로소디에틸아민) 검출 여부 등에 대한 조사 결과도 발표했다.
NDEA 검사 결과, 1개 원료의약품이 잠정 관리기준을 초과했으나 해당 품목은 이미 판매 중지된 상태로 나타났다.
중국 화하이로부터 수입한 사르탄 계열 원료의약품 중 이르베사르탄(원료 2개사 2품목, 완제 10개사 21품목) 및 올메사르탄(원료 3개사 3품목, 완제 6개사 17품목)은 NDMA와 NDEA 모두 잠정 관리기준 이하로 확인됐다.
화하이의 로사르탄(원료 8개사 8품목, 완제 71개사 140품목) 함유 의약품에서는 NDMA가 검출되지 않았다.
NDEA의 경우 일양약품의 '일양로자탄정' 제조라인 일부만 잠정 관리기준을 벗어났으나 현재 해당 품목은 유통되지 않는 것으로 확인됐다. 문제가 된 제품은 이미 유효기간이 가까워진 상태여서 약국에서 더는 조제·판매되지 않고 있다.
만약에 이 제품을 하루 최고용량으로 3년간 계속 복용하더라도 추가 발암 가능성은 10만명 중 0.06명으로 위해 우려는 거의 없는 수준이다.
이밖에 해외에서 문제가 된 인도 헤테로의 로사르탄과 인도 아우로빈도의 이르베사르탄은 NDMA 및 NDEA가 잠정 관리기준 이하이거나 수입실적이 없는 것으로 조사됐다.
breezy@greenpost.kr